家用水滴超声美容仪在美国是否属于医疗器械,取决于其技术原理、预期用途和宣传声称。根据美国食品药品监督管理局(FDA)的监管框架,此类产品通常被认定为医疗器械,但具体分类和合规要求需结合以下关键因素综合判断:
根据《联邦食品、药品和化妆品法案》(FD&C Act),医疗器械需满足以下任一条件:
用于诊断、预防、治疗疾病;
影响人体结构或功能(即使无治疗疾病声称)。
水滴超声美容仪若宣传具有紧致皮肤、促进胶原再生、改善皱纹等功效,即被视为“影响人体结构或功能”,从而纳入医疗器械监管范畴。
FDA根据风险将医疗器械分为三类,水滴超声美容仪通常属于 I类或II类:
Class I(低风险,约占47%)
企业注册(FDA FURLS系统)及产品列名;
符合标签规范(英文说明书、警告信息);
部分产品豁免510(k),但需满足质量体系QSR 820(GMP)。
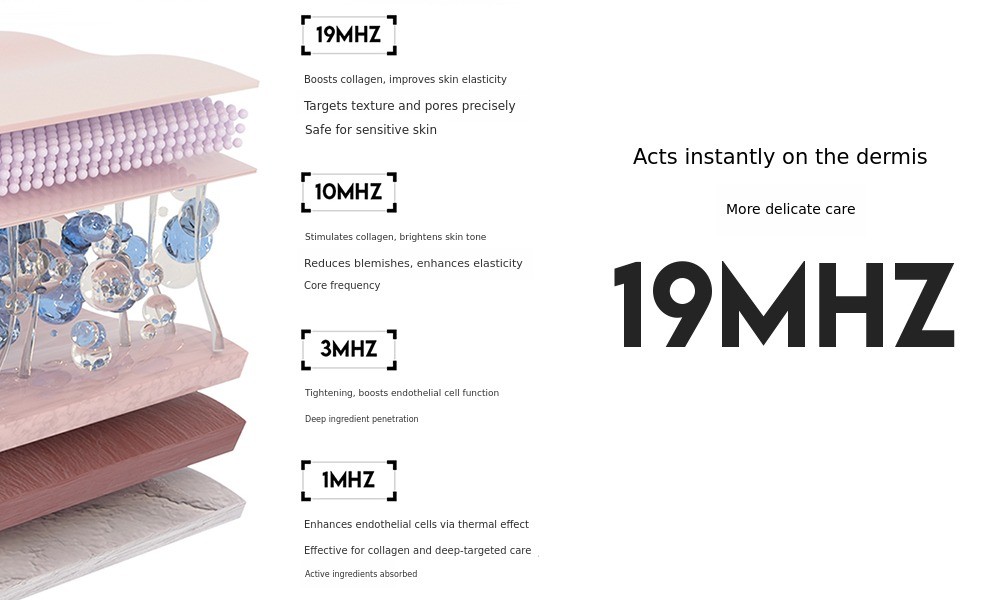
适用情形:仅用于基础护肤(如清洁、保湿),无深入真皮层作用的超声设备。
要求:
Class II(中风险,约占46%)
必须提交510(k)申请,证明与已上市“对比器械”实质等同(如类似功能的超声设备);
需提供性能测试、生物相容性数据;
符合特殊控制标准(如输出能量限制、临床安全性报告)。
适用情形:若超声能量穿透至真皮层,或声称具有“抗衰”“修复”等医疗效果(如模拟CO₂激光的皮肤重建)。
要求:
分类确认(关键步骤)
如CO₂激光治疗仪因涉及“软组织消融”被列为Class II,需510(k);
普通按摩仪(仅表皮作用)通常为Class I。
通过FDA产品代码数据库(如Product Code "LZR"对应超声治疗设备)或第三方机构查询分类。
参考类似产品案例:
上市前申请
Class I豁免510(k)产品:仅需企业注册(年费约$6,000)+产品列名。
Class II产品:需提交510(k),周期约4-6个月,费用$22,000+。
质量体系与标签
所有类别均需符合QSR 820质量规范(设计控制、生产记录);
标签需包含:适用部位、禁忌症、副作用警告(如“禁止用于眼部”)。
上市后监管
建立不良事件报告系统(如用户烫伤需上报FDA)。
是否属于医疗器械?
✅ 是。只要涉及影响皮肤结构或功能,无论家用还是医用,均受FDA监管。
分类及合规路径:
低风险场景(基础清洁):Class I,豁免510(k),注册+列名即可;
中高风险场景(抗衰修复):Class II,需510(k) + 性能验证。
| 判断要素 | Class I(低风险) | Class II(中风险) |
|---|---|---|
| 适用情形 | 仅用于基础护肤(如清洁、保湿),无深入真皮层作用 | 超声能量穿透至真皮层,或宣传“抗衰”“修复”等医疗效果 |
| 核心要求 | • 企业注册与产品列名 • 符合标签规范 • 部分产品豁免510(k) | • 必须提交510(k)申请 • 提供性能测试和生物相容性数据 • 符合特殊控制标准 |
| 典型流程 | 企业注册(年费约$6,000) + 产品列名 | 510(k)申请(周期4-6个月,费用$22,000+) |
| 质量体系 | 需符合QSR 820(GMP)规范 | 需符合QSR 820(GMP)规范 |
| 上市后监管 | 建立不良事件报告系统 | 建立不良事件报告系统 |
风险规避建议:
避免在宣传中使用“治疗”“修复”等医疗术语;
委托合规机构进行产品代码匹配(如参考:CO₂激光仪分类案例);
若出口无FDA认证产品,可能被海关扣留或面临警告信。
建议通过FDA官方数据库Device Classification进一步确认分类,或咨询专业代理机构(如微珂咨询)以降低合规风险



Copyright © 上海美容仪器厂|上海美容仪器公司|上海洁面仪oem|美容仪器—云惠智能工厂备案号:蜀ICP备18029467号订阅 / 站点地图
技术支持:@2019-2025
 扫一扫咨询微信客服
扫一扫咨询微信客服